创伤性脑损伤(TBI)通常是由车祸、跌倒、接触性运动或攻击造成的。仅在美国,TBI的年发病率就高达350万,目前有500万人具有TBI相关的残疾,每年花费约800亿美元。
目前,TBI的治疗主要集中在稳定患者病情和缓解症状上,还没有专门针对脑损伤后驱动神经变性的病理生理过程的药物。TBI还显著增加了日后患阿尔茨海默病(AD)的风险。这表明了两者之间可能具有共同的病理机制,新出现的证据指向S-亚硝基化和乙酰化。
事实上,最近一项小型尸检研究报告了3名AD患者和3名慢性创伤性脑病患者大脑中tau在赖氨酸(K)280处的乙酰化增加。在一项单独的研究中,在另外10名AD患者、5名皮质基底变性患者和5名进行性核上性麻痹患者的大脑中,K280处的tau乙酰化也有同样的上升记录。另外,在多达十余名重度AD患者中,研究人员发现了K274和K281处的Tau乙酰化。
然而,这些研究并没有确立研究结果的驱动力或病理意义。鉴于TBI和AD之间的相互关系,研究人员正在试图确定tau乙酰化程度的升高是否是TBI中的一个因果性病理生理因素,从而是一个潜在的汇合点,如果是这样,那么这是否可以提供一个实验平台来理解与大脑中tau乙酰化相关的体内病理生理学。
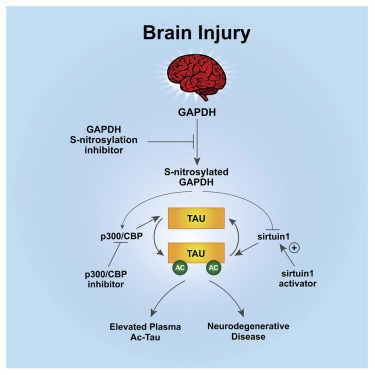
最近,研究人员在Cell杂志发文报告,TBI可以诱导tau乙酰化(ac-tau),该乙酰化位点在患有AD的人类脑中也存在。这是由S-亚硝基化的GAPDH介导的,它可以同时灭活Sirtuin1去乙酰化酶和激活p300/CBP乙酰转移酶,增加神经元中tau蛋白的乙酰化。随后tau蛋白的错位导致神经变性和神经行为障碍,以及乙酰化的tau在血液中的积累。
GAPDH的S-亚硝基化介导tau乙酰化的增加
阻断GAPDH的S-亚硝基化,抑制p300/CBP,或激活Sirtuin1,都能减轻小鼠在TBI后的神经变性、神经行为障碍以及血液和大脑中乙酰化tau的积累。
在有TBI史的AD患者中,其脑中乙酰化tau蛋白的增加会进一步增强,接受p300/CBP抑制剂salsalate或diflunisal的患者则表现出AD和临床诊断TBI的发生率降低。
因此,tau蛋白的乙酰化是TBI的治疗靶点和潜在的血液生物标志物,可能代表了TBI和AD之间的病理融合。
了解更多Abebio相关产品:
Cindy