影响E.coli 中蛋白表达量的因素除载体启动子结构以外,还有质粒拷贝数、质粒稳定性、mRNA结构、密码子的偏爱性和宿主菌的生长状态等因素。由于Vector NTI suitor7.0软件模拟表达,可知mRNA结构和密码子的偏爱性两个影响因素不会造成表达困难,所以本实验的工作主要针对载体拷贝数、载体稳定和宿主菌的生长状态。
本实验中重组表达质粒PrP-pET-32a(+)不稳定的原因可能是PrP对E.coli BL21(DE3)具有细胞毒性。pET-32a(+)来源于pBR-322,pBR-322源于ColE1。ColE1、pBR-322 、pET-32a(+)都失去了分配功能区par。而天然质粒具有功能区par,可以保证质粒在每次细胞周期中准确的进行分离,并均等的分配到子代细胞中去。功能区par对质粒PrP-pET-32a(+)的稳定性是不可缺少的。缺少功能区par的pET-32a(+)质粒在每次细胞周期中随机分配到子代细胞中去,无细胞毒性时约98% E.coli BL21(DE3)会带有质粒(见《pET System Manual》34页)。表达有细胞毒性蛋白的E.coli BL21(DE3)不具有生长优势,而且随细菌培养时间的增加β-内酰氨酶将逐渐释放到溶液中去,破坏溶液中的AMP。【β-内酰氨酶功能强大,细菌培养稀释1000倍以后还能破坏几乎所有的AMP(见《pET System Manual》33页)】。这样本不具有生长优势的表达菌又失去了选择压力,造成大部分新生细菌无质粒,表现为表达困难。本实验证实约60%以上的细菌无质粒。
鉴于以上原因,本实验将融合蛋白Trx-PrPC27-30表达分成两个阶段,前一个阶段为质粒生长阶段,主要保证质粒的稳定性和提高质粒的拷贝数;后一个阶段为融合蛋白表达阶段,待细菌生长达饱和以后,诱导融合蛋白Trx-PrPC27-30的表达。
在温度、AMP浓度、培养基等诸多影响质粒PrP-pET-32a(+)稳定性的因素中,以温度影响最为明显。实验结果显示,37℃条件下约60%以上的细菌无质粒PrP-pET-32a(+),25℃条件下失去质粒PrP-pET-32a(+)的细菌在约10%以内。其他条件不变,AMP浓度在100 μg/ml以上细菌质粒PrP-pET-32a(+)基本稳定。随AMP浓度增加平板上的菌落逐渐变小,表明AMP可抑制细菌生长。不同培养基对PrP-pET-32a(+)的稳定性无明显影响,但TB培养基可提高蛋白表达量。实验发现TB培养基比LB提高蛋白表达量约在5-10%之间。
本实验中PrP-pET-32a(+)稳定性高则融合蛋白Trx-PrPC27-30表达量高。
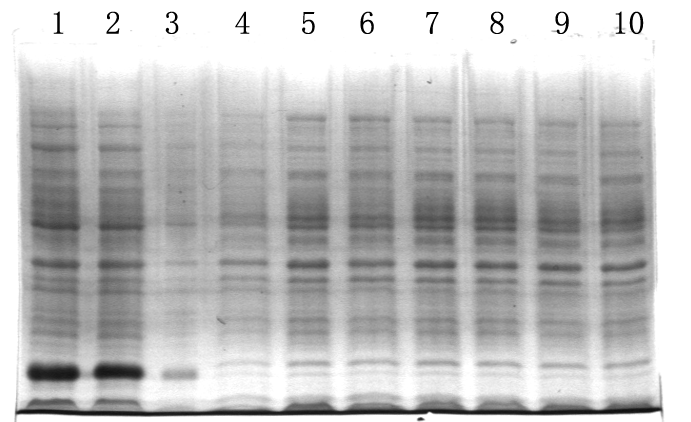
温度因素是影响本实验融合蛋白表达量最为明显的因素。如下图,37℃条件下,其他条件不管如何改变,都未见融合蛋白Trx-PrPC27-30有明显表达。
37℃不同诱导条件下融合蛋白Trx-PrPC27-30表达量的影响
Fig.2-9 Expression of Trx-PrPC27-30 fusion protein treated with different condition at 37℃(12% SDS-PAGE)
1 pET-32a(+)control
2 pET-32a(+)control
3 induce at 37℃,AMP 50 ug/ml,IPTG 1 mM,1h
4 induce at 37℃,AMP 50 ug/ml,IPTG 1 mM,3h
5 induce at 37℃,AMP 50 ug/ml,IPTG 1 mM,12h
6 induce at 37℃,AMP 50 ug/ml,IPTG 5 mM,12h
7 induce at 37℃,AMP 100 ug/ml,IPTG 1 mM,12h
8 induce at 37℃,AMP 200 ug/ml,IPTG 1 mM,12h
9 induce at 37℃,AMP 50 ug/ml,IPTG 1 mM,12h
10 induce at 37℃,AMP 50 ug/ml,lactose 1%,12h
带ColE1复制起点的质粒,在加入氯霉素以后可以抑制细菌蛋白的生长,但不抑制质粒拷贝数的增加。虽然没有文献可以解释这一现象,我们仍可以推测导致质粒拷贝数增加的蛋白合成系统是独立于细菌蛋白合成系统的,这个系统以一种相对稳定速度合成质粒。所以降低细菌生长速度可增加细菌质粒拷贝数(并间接增加质粒稳定性)从而增加融合蛋白Trx-PrPC27-30的表达量。本实验在37℃条件下,诱导前OD600为0.6时开始诱导,4 h诱导培养 ,菌液的OD600值可达5,未见融合蛋白Trx-PrPC27-30的明显表达;25℃条件下,诱导前OD600为1.5,更换等体积新鲜TB诱导4h,菌液的OD600值可达2.3,融合蛋白Trx-PrPC27-30的最高表达量接近50%。变化如此之大,出乎意料。
AMP浓度是继温度条件以后,影响融合蛋白表达量的另一个重要因素。当其他条件不变,AMP浓度在50 μg/ml以下时,融合蛋白Trx-PrPC27-30的表达量在20%以下;AMP浓度在200-500 μg/ml条件下,Trx-PrPC27-30呈高表达,表达量接近50%。但AMP浓度加到500 μg/mlAMP时则会使细菌的生长速度下降。说明一定的选择压力可以提高质粒的稳定性从而提高融合蛋白表达量,200 μg/ml的AMP浓度为最适表达浓度。
不同IPTG浓度对融合蛋白Trx-PrPC27-30的表达量无明显影响,0.1 mM的IPTG即可达到38%的表达量,1 mM IPTG可达最高表达量;乳糖诱导条件下融合蛋白Trx-PrPC27-30的表达量随乳糖浓度增加而逐渐增加,但乳糖诱导融合蛋白Trx-PrPC27-30的最高表达量(39.6%)比IPTG诱导的最高表达量(45.7%)低。可能是由于乳糖提高了细菌的生长速度,间接降低了质粒的拷贝数,导致表达量下降。乳糖浓度太低时,细菌在诱导表达早期已将乳糖消耗干净,造成诱导不足;乳糖浓度太高,细菌的生长速度过快,降低了质粒的拷贝数,融合蛋白Trx-PrPC27-30的表达量又有所下降。所以乳糖诱导表现为融合蛋白Trx-PrPC27-30的表达量,随乳糖浓度增加由低到高,然后又略有下降。当其他条件不变时,用3%乳糖诱导融合蛋白Trx-PrPC27-30可达最高表达量,而8%乳糖诱导表达量有所下降。
随诱导时间的增加融合蛋白Trx-PrPC27-30的表达量均匀增加,3 h以后接近最高表达量,过夜诱导最高表达量可达47%,甚至接近50%。诱导过程中细菌OD600变化不大,由1.5上升为2.0-2.5。与此不同的是,37℃诱导条件下,无融合蛋白Trx-PrPC27-30表达时,细菌OD600值变化很大,诱导4 h,细菌OD600值由0.6上升为5,表明细菌分裂并不是表达融合蛋白所需,甚至可导致蛋白表达量下降。细菌生长接近饱和以后,更换等体积新鲜培养基诱导,可获得高的蛋白表达量。